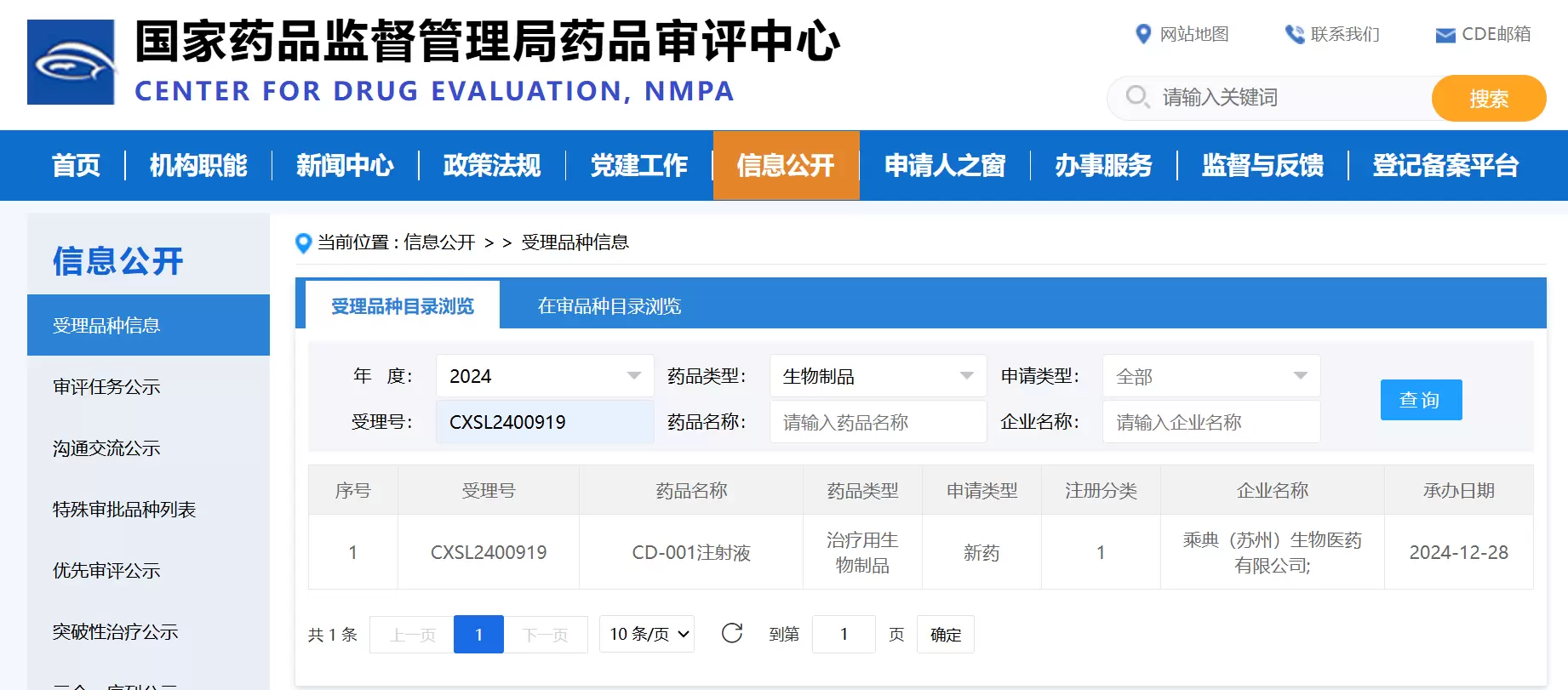
乘典(苏州)生物医药有限公司今日宣布,公司首发项目CD-001在获得美国食品药品监督管理局(FDA)和中国国家药品监督管理局(NMPA)晚期实体瘤适应症临床默许后,用于治疗晚期恶性血液肿瘤的新适应症临床申请又获得中国国家药品监督管理局药品审评中心(CDE)正式受理,受理号为:CXSL2400919。此次国内临床新适应症受理表明该药物在肿瘤治疗领域具有广泛的应用潜力,也标志着该药物即将进入多适应症临床研究的加速开发阶段。
关于CD-001
CD-001是乘典(苏州)生物针对目前临床PD-1抑制剂肿瘤治疗有效率不高的问题,自主研发的一种靶向肿瘤反应性CD8+T细胞的IL-21融合蛋白药物,在阻断PD-1免疫抑制信号的同时,体内选择性扩增肿瘤反应性CD8+T细胞,可显著提高免疫治疗的疗效。在临床前研究中,CD-001在多种小鼠肿瘤模型中表现出显著的抗肿瘤治疗效果,同时在非人灵长类动物毒理研究中展现了良好的安全性和药代动力学特性。目前该药物用于治疗晚期实体瘤的适应症已获美国食品药品管理局(FDA)及中国国家药品监督管理局(NMPA)的IND批准,血液肿瘤IND申请已获得NMPA正式受理。
关于乘典生物
乘典(苏州)生物医药有限公司成立于2021年4月,由资深免疫学家和具有丰富制药行业经验的资深专家组成,公司总部位于中国苏州,在北京设有分支机构。乘典生物的愿景是通过靶向特定免疫细胞,精准调控免疫反应策略,开发新一代的免疫治疗药物,最终改善和提高免疫相关疾病患者的生活质量。